- 제목
- 권호정 교수 공동연구팀, 단백질-단백질 상호작용을 조절할 수 있는 생분해성 암치료제 개발
- 작성일
- 2024.01.11
- 작성자
- 생명공학과
- 게시글 내용
-
- 궁극적으로 프로테옴 기능의 조절을 통한 수많은 질병 치료가 가능한 스마트 약물 전달 시스템 개발의 초석 마련
약물전달 분야 세계적 학술지 ‘Journal of Controlled Release’ 게재

그림1. 왼쪽부터 연세대학교 임용범 교수, 권호정 교수, 구희범교수, 황현석 연구원
연세대학교 신소재공학과 임용범 교수, 연세대학교 생명공학과 권호정 교수, 그리고 가톨릭 의과대학 구희범 교수로 이루어진 공동연구팀은 낮은 약물동태학(pharmacokinetics) 특성을 보이는 기존 펩타이드 약물의 단점을 보완할 수 있는 나노바이오소재를 개발하였다. 이번에 개발한 자가조립 뎁시펩타이드 나노구조체(self-assembling depsipeptide nanostructure, SdPN)는, 높은 생체 안정성과 암조적 타겟팅 능력을 가지며, 세포 안에 도달하면 주위의 환경을 인식한 후 자동적으로 생분해가 되어 PPI 저해 항암 펩타이드를 방출하는 스마트 약물 전달 시스템이다.
세포 내 신호전달에 관여하는 단백질-단백질 상호작용(protein-protein interaction; PPI)은 유망한 약물 타겟으로 간주되고 있지만, 현재로선 적합한 약물을 개발하기에 매우 까다로운 타겟이다. 구조적 특성상 PPI는 넓고 얕은 결합면으로 이루어지기 때문에, 기존의 소분자(small molecule)를 이용한 약물의 개발이 쉽지 않은 실정이다. 이에 다양한 기능성 잔기들을 가지고 있으며, 안정적인 이차 구조를 형성할 수 있고, PPI interface에 알맞은 크기를 가진 펩타이드는 효과적인 PPI 억제제로 작용할 수 있다. 하지만, 펩타이드는 생체 내에서 약물의 신속한 가수분해(proteolytic digestion), 낮은 세포막 투과성 (cell membrane permeability), 낮은 생체 이용률(bioavailability), 신장에서의 높은 제거율(renal clearance) 등과 같은 좋지 않은 약물동태학적 특성로 인해 펩타이드 약물 상용화가 쉽지 않은 상황이다.
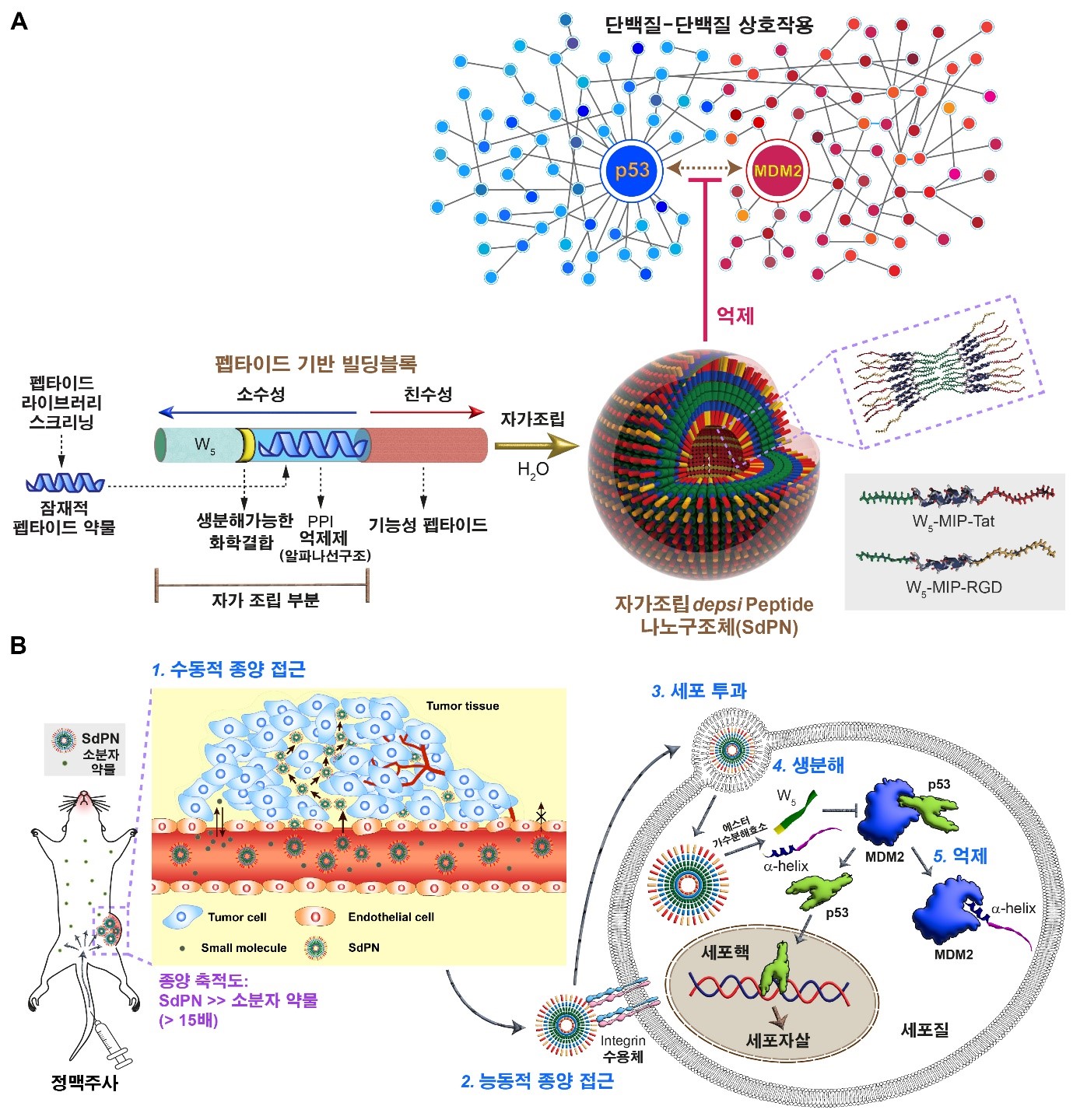
그림2. 연구 개요 (A) 단백질-단백질 간 상호작용을 억제할 수 있는 자가조립 뎁시펩타이드 나노구조체(SdPN)의 구성요소 및 자가조립 나노구조체의 구조. (B) SdPN의 암조직 제거 작동 메커니즘.
PPI는 비극성표면을 통한 소수성 상호작용을 결합의 주요 원동력으로 사용한다. 특히, PPI interface에서 핵심적인 역할을 하는 hot spot은 대부분 소수성을 띠는 동시에 alpha-helix의 형태로 존재하여, 타이트하고 특이적인 PPI를 가능하게 만들고 있다. 이에 펩타이드 라이브러리 스크리닝 기술을 활용하여 PPI interface와 강력하게 상호작용할 수 있는 alpha-helix 기반의 펩타이드 약물을 찾는 연구는 활발히 진행 중에 있다.
이를 해결하기 위해, 본 연구에서는 PPI를 억제할 수 있는 alpha-helix를 포함하는 자가조립 뎁시펩타이드 나노구조체(self-assembling depsipeptide nanostructure, SdPN)를 개발하였다. SdPN은 체내에서 자가조립을 유도하는 소수성 코어 부분, 소수성 코어 부분과 에스테르 결합으로 연결되어 세포 내 전달 이후 생분해를 통해 방출될 수 있는 alpha-helix 펩타이드 약물 부분, 세포 투과 펩타이드 부분으로 이루어져 있다. Alpha-helix 펩타이드 약물 부분은 hot spot이 주로 소수성 잔기로 이루어져 있다는 것에 착안하여, 자가조립(self-assembly) 과정에 참여하게 디자인하였다. 합성한 펩타이드를 물에 녹이면 자가조립을 통하여 자동적으로 분자들이 모여 나노캡슐 모양의 구조를 만드는 것을 검증하였다(그림 A). 해당 구조체의 alpha-helix 펩타이드 약물 부분은 암세포의 세포자살에 관련된 p53과 MDM2 간 상호작용을 억제하는 MDM2 Inhibitory Peptide (MIP)로 구성하였다. SdPN은 체내환경에서 안정적인 alpha-helix 구조를 유지하고 있었으며, 세포 내 전달 후 소분자 약물의 급격한 억제 작용과는 대조적으로 에스터 결합의 점진적인 생분해를 통하여 펩타이드 약물을 서서히 방출(controlled release)하였다(그림 B). 또한 동물 실험 결과, 소분자 약물 대비 고효율로 종양에 전달되어 강력한 항암 효과를 보이는 것을 확인하였다.
SdPN은 모듈형이기 때문에, MIP외에 다른 약물로의 교체가 자유로운 것이 특징이다. 따라서, 범용성 PPI 조절 플랫폼으로 개발될 수 있다는 특장점이 있다.
이번 논문은 최세환, 황현석, 한성령 연구원이 공동 제1저자로, 엄호현, 최준식, 한상헌, 이동현,이수연 연구원이 공동 저자로 그리고 임용범 교수, 권호정 교수, 구희범 교수가 교신저자로 참여하였으며, 한국연구재단, 연세대학교 ICONS 사업, 가톨릭 교육 재단의 연구비 지원으로 진행되었다. 본 논문은 약물전달 분야의 세계적인 학술지인 Journal of Controlled Release (IF = 10.8 ; JCR 상위 3.9%)에 2024년 1월 게재되었다.
논문정보
논문제목: Inhibition of protein-protein interactions using biodegradable depsipeptide nanoassemblies
논문주소: https://doi.org/10.1016/j.jconrel.2023.12.028.
